Calorimetría y Cinética Química: Medición de Calor y Velocidad de Reacciones
Clasificado en Química
Escrito el en  español con un tamaño de 428,01 KB
español con un tamaño de 428,01 KB
Fundamentos de Calorimetría y Cinética Química
Calorimetría: Medición del Flujo de Calor
La calorimetría es la rama de la Física que se encarga de la medición del flujo de calor en una reacción química o proceso físico, utilizando un calorímetro.
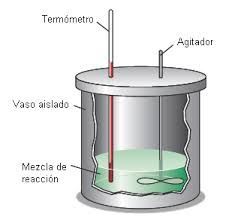
Capacidad Calorífica y Calor Específico
El cambio de temperatura que experimenta un objeto cuando absorbe o libera cierta cantidad de calor se determina mediante su capacidad calorífica (C).
La capacidad calorífica de un objeto es la cantidad de calor requerida para elevar su temperatura en 1 K (o 1 °C).
¿Qué significa un valor alto de capacidad calorífica?
A mayor capacidad calorífica, mayor cantidad de calor se requerirá para ocasionar un incremento determinado en la temperatura de una sustancia.
La capacidad calorífica molar (Cm) es la capacidad calorífica de un mol de una sustancia.
El calor específico (Cs) es la cantidad de calor que se necesita por unidad de masa para elevar la temperatura en 1 °C o 1 K.
Por lo tanto, el calor específico para el agua también puede reportarse como:
Cálculo del Calor en Disoluciones
El valor de q(disolución) se calcula fácilmente a partir de la masa de la disolución, su calor específico y el cambio de temperatura.
La relación fundamental en calorimetría para sistemas aislados es:
q(disolución) = -q(reacción)
Cinética Química: Estudio de la Velocidad de Reacción
Introducción a la Cinética Química
La cinética química es el área de la Química que se ocupa del estudio de la velocidad, o rapidez, con que ocurre una reacción química, así como de los factores que la afectan y los mecanismos por los que transcurre.
Velocidad de Reacción
La velocidad de reacción se refiere al cambio en la concentración de un reactivo o de un producto respecto al tiempo (expresado comúnmente en M/s).
Algunos ejemplos donde es importante considerar la velocidad de reacción son:
- La rapidez con que surte efecto un medicamento en el cuerpo.
- Los procesos que forman y destruyen el ozono en la atmósfera.
- El procesamiento y conservación de alimentos.
Factores que Afectan la Velocidad de Reacción
Cuatro factores principales permiten modificar la velocidad con que ocurre una reacción en particular:
- Estado físico de los reactivos: Las reacciones son más rápidas cuando los reactivos están en el mismo estado físico o cuando la superficie de contacto es mayor.
- Concentraciones de los reactivos: Generalmente, a mayor concentración de reactivos, mayor velocidad de reacción.
- Temperatura de la reacción: Un aumento de temperatura suele incrementar la velocidad de reacción.
- La presencia de un catalizador: Los catalizadores aceleran las reacciones sin consumirse.
El Papel de los Catalizadores
Los catalizadores son sustancias que aumentan las velocidades de reacción sin consumirse en el proceso. Afectan los tipos de colisiones entre las moléculas (y, por lo tanto, alteran el mecanismo de reacción), lo que conduce a una vía de reacción con menor energía de activación.
Expresión de la Velocidad de Reacción
Para una reacción genérica, la velocidad puede expresarse como la velocidad de desaparición de un reactivo o como la velocidad de aparición de un producto.
Donde Δ[A] y Δ[B] representan los cambios en la concentración (molaridad) durante un periodo de tiempo determinado, Δt.
Dado que la concentración de un reactivo (como A) disminuye durante un intervalo, Δ[A] es una cantidad negativa. Por convención, la velocidad de reacción se expresa como un valor positivo.
Velocidad Promedio de Reacción
La medición del cambio de la concentración desde un tiempo inicial hasta un tiempo final permite determinar la velocidad promedio de la reacción durante ese intervalo.
Ejemplo de Expresiones de Velocidad
A continuación, se presentan ejemplos de cómo escribir las expresiones de velocidad para reacciones, en función de la desaparición de los reactivos y de la aparición de los productos:
Ley de Velocidad y Constante de Velocidad
La dependencia de la velocidad de reacción con las concentraciones de los reactivos se describe mediante la ley de velocidad.
Donde k es la constante de velocidad, un valor específico para cada reacción a una temperatura dada.
