Metabolisme Cel·lular: Beta-oxidació, Cetogènesi i Glucòlisi
Clasificado en Biología
Escrito el en  catalán con un tamaño de 11,21 KB
catalán con un tamaño de 11,21 KB
La Beta-oxidació: Degradació d'Àcids Grassos
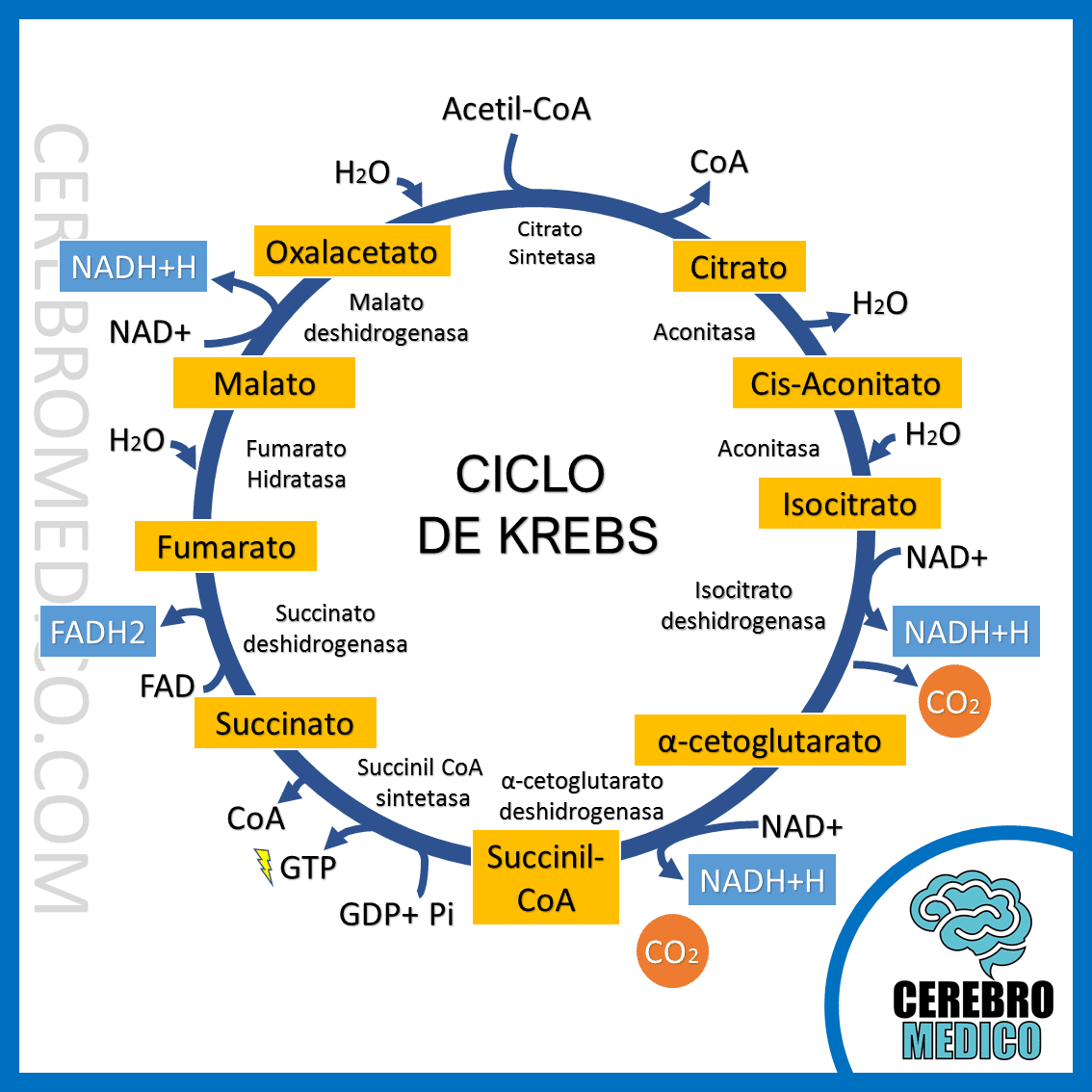
La beta-oxidació és la via metabòlica encarregada de degradar els àcids grassos per obtenir energia. Concretament, transforma els àcids grassos en acetil-CoA, que entra al cicle de Krebs per continuar la producció energètica. A més, durant aquest procés es generen coenzims reduïts (NADH i FADH₂), que s'utilitzen a la cadena de transport electrònic per a la síntesi d'ATP. És una via clau durant períodes de dejuni o exercici prolongat.
Localització de la Beta-oxidació
La beta-oxidació té lloc a la matriu mitocondrial. Els àcids grassos, abans de ser degradats, són activats al citosol en forma d'acil-CoA. Posteriorment, són transportats a través de la membrana mitocondrial interna mitjançant el cicle de la carnitina, que permet l'entrada d'acils de cadena llarga a la mitocòndria.
Mecanisme de la Beta-oxidació
El procés de beta-oxidació consisteix en un cicle de quatre reaccions principals que es repeteixen:
- Oxidació: L'acil-CoA es transforma en trans-Δ²-enoil-CoA, generant FADH₂.
- Hidratació: S'afegeix una molècula d'aigua, formant L-β-hidroxiacil-CoA.
- Segona oxidació: S'oxida a β-cetoacil-CoA, generant NADH.
- Tiòlisi: Es trenca la molècula, alliberant un acetil-CoA i un acil-CoA escurçat.
Regulació de la Beta-oxidació
La beta-oxidació està regulada per diversos mecanismes:
- A nivell hormonal:
- Estimulada pel glucagó i l'adrenalina.
- Inhibida per la insulina.
- A nivell intracel·lular:
- El malonil-CoA (intermediari de la síntesi d'àcids grassos) inhibeix l'entrada dels àcids grassos a la mitocòndria a través del cicle de la carnitina.
- En estats de dejuni o exercici, hi ha una mobilització d'àcids grassos del teixit adipós, incrementant la beta-oxidació.
- La disponibilitat d'oxigen i de NAD⁺/FAD també és clau per mantenir activa la via.
Cossos Cetònics: Font d'Energia Alternativa
Què són els Cossos Cetònics?
Els cossos cetònics són molècules derivades de l'acetil-CoA que se sintetitzen al fetge quan l'organisme necessita una font alternativa d'energia. Els principals són:
- Acetoacetat
- D-β-hidroxibutirat
- Acetona (no metabolitzable, eliminada per l'alè o l'orina)
Síntesi dels Cossos Cetònics (Cetogènesi)
La cetogènesi té lloc a la mitocòndria dels hepatòcits, a partir de l'acetil-CoA que prové de la beta-oxidació dels àcids grassos. Quan la disponibilitat de glucosa és baixa, l'oxalacetat (OAA) es destina preferentment a la gluconeogènesi i no pot combinar-se amb l'acetil-CoA per entrar al cicle de Krebs. Això provoca una acumulació d'acetil-CoA, que es canalitza cap a la formació de cossos cetònics.
Inducció de la Cetogènesi en Glucèmia Baixa
Quan hi ha un baix nivell de glucosa a la sang (dejuni prolongat, dieta hipoglucídica o diabetis no controlada), el cos activa mecanismes compensatoris:
- Es mobilitzen els triacilglicèrids del teixit adipós, alliberant àcids grassos.
- Aquests àcids grassos entren al fetge i pateixen beta-oxidació, generant grans quantitats d'acetil-CoA.
- A causa de la glucèmia baixa, el fetge prioritza la gluconeogènesi, desviant l'OAA cap a la síntesi de glucosa i frenant el cicle de Krebs.
- L'excés d'acetil-CoA s'utilitza per sintetitzar cossos cetònics que són alliberats a la sang.
- Aquests compostos són captats per altres teixits (com el cervell, múscul cardíac i esquelètic) i utilitzats com a font d'energia alternativa.
Funció Fisiològica dels Cossos Cetònics
Els cossos cetònics permeten mantenir l'aport energètic en situacions de dèficit de glucosa, evitant l'esgotament de proteïnes i glucogen. Són especialment importants durant el dejuni, l'estrès metabòlic o en estats patològics com la diabetis mellitus.
Biosíntesi dels Àcids Nucleics: ADN i ARN
Els àcids nucleics (ADN i ARN) estan formats per nucleòtids, que poden sintetitzar-se mitjançant dues vies: la via de recuperació i la síntesi de novo. La síntesi de novo és la via per la qual la cèl·lula genera nucleòtids a partir de precursors simples. A continuació, s'expliquen les etapes de la síntesi de novo per a les purines i les pirimidines, destacant les diferències principals entre ambdues.
Síntesi de Novo de Purines
La biosíntesi de purines comença amb la ribosa-5-fosfat, derivada de la via de les pentoses fosfat, que es transforma en PRPP (fosforribosilpirofosfat) per acció de la PRPP sintetasa. Sobre aquesta estructura es construeix gradualment l'anell purínic mitjançant afegits successius de diversos compostos: glutamina, glicina, aspartat, CO₂ i dos grups formil (aportats per formil-THF). Aquest procés requereix l'ús de 7 molècules d'ATP. El producte intermedi que es forma és IMP (inosina monofosfat), que actua com a precursor comú tant per a l'AMP (adenosina monofosfat) com per a la GMP (guanosina monofosfat), que es formen en rutes divergents segons les necessitats cel·lulars.
Síntesi de Novo de Pirimidines
A diferència de les purines, en la síntesi de pirimidines, l'anell base es forma abans de la unió amb el PRPP. El procés s'inicia amb la formació del compost carbamoilfosfat, a partir de glutamina i CO₂, catalitzada per la carbamoilfosfat sintetasa II. Aquest compost es combina amb aspartat, donant lloc a una sèrie de reaccions catalitzades per un complex enzimàtic multifuncional anomenat CAD, que inclou les activitats de carbamoilfosfat sintetasa, aspartat transcarbamoilasa i dihidroorotasa. El producte final d'aquesta fase és orotat. L'orotat s'uneix al PRPP per formar OMP (orotidina monofosfat), que es converteix en UMP (uridina monofosfat). A partir d'aquest, es formen altres nucleòtids com CMP (citosina monofosfat) o TMP (timidina monofosfat), mitjançant la conversió de l'UMP en dUMP i l'acció de la timidilat sintasa, amb transferència d'un grup metil (aportat per THF).
Diferències Clau entre Purines i Pirimidines
Les purines i les pirimidines es diferencien tant en la seva estructura com en la seva biosíntesi:
- Les purines tenen una estructura bicíclica i se sintetitzen directament sobre el PRPP.
- Les pirimidines són monocícliques i la seva base es forma abans de la unió amb el PRPP.
- Els precursors són diferents: les purines requereixen glutamina, glicina, aspartat, CO₂ i formil-THF, mentre que les pirimidines utilitzen glutamina, CO₂ i aspartat.
- Finalment, el precursor comú de les purines és IMP, mentre que el de les pirimidines és OMP.
La Glucòlisi: Descomposició de la Glucosa per a Energia
La glucòlisi és una via metabòlica fonamental que té lloc al citosol de totes les cèl·lules. Consisteix en la transformació d'una molècula de glucosa (6 carbonis) en dues molècules de piruvat (3 carbonis). Durant aquest procés s'obtenen molècules d'ATP, que aporten energia immediata, i NADH, que servirà com a poder reductor en la cadena respiratòria si hi ha oxigen disponible.
La glucòlisi es pot dividir en tres grans fases:
Fase 1: Activació de la Glucosa (Inversió d'ATP)
- Glucosa → Glucosa-6-fosfat (G6P): Aquesta reacció és catalitzada per l'enzim hexocinasa (o glucoquinasa en el fetge) i consumeix una molècula d'ATP. El grup fosfat impedeix que la glucosa surti de la cèl·lula, ja que la G6P no pot travessar la membrana plasmàtica.
- Glucosa-6-fosfat → Fructosa-6-fosfat (F6P): Aquesta conversió és realitzada per la fosfoglucosa isomerasa, i transforma una aldohexosa (glucosa) en una cetohexosa (fructosa).
- Fructosa-6-fosfat → Fructosa-1,6-bisfosfat (F1,6bP): La reacció és catalitzada per l'enzim clau fosfofructocinasa-1 (PFK-1) i implica el consum d'un altre ATP. És el pas limitant i regulador de la via, inhibida per ATP i activada per AMP.
Fase 2: Escissió i Preparació
- Fructosa-1,6-bisfosfat → Gliceraldehid-3-fosfat (G3P) + Dihidroxiacetona fosfat (DHAP): Aquesta reacció de trencament és catalitzada per aldolasa. El resultat són dues trioses fosfat.
- Dihidroxiacetona fosfat ⇌ Gliceraldehid-3-fosfat (G3P): Només el G3P pot continuar per la via, de manera que la triosa fosfat isomerasa transforma el DHAP en G3P. A partir d'aquí, totes les reaccions es dupliquen (una per cada G3P).
Fase 3: Obtenció d'Energia (Producció d'ATP i NADH)
- Gliceraldehid-3-fosfat → 1,3-bisfosfoglicerat: Reacció catalitzada per gliceraldehid-3-fosfat deshidrogenasa (GAPDH). S'hi oxida el G3P i es redueix NAD⁺ a NADH + H⁺.
- 1,3-bisfosfoglicerat → 3-fosfoglicerat: En aquesta reacció, catalitzada per fosfoglicerat cinasa, es forma un ATP per fosforilació a nivell de substrat.
- 3-fosfoglicerat → 2-fosfoglicerat: Conversió catalitzada per fosfoglicerat mutasa, que reorganitza el fosfat dins la molècula.
- 2-fosfoglicerat → Fosfoenolpiruvat (PEP): L'enzim enolasa elimina una molècula d'aigua, generant una molècula d'alta energia.
- Fosfoenolpiruvat → Piruvat: Reacció catalitzada per piruvat cinasa, que genera un altre ATP per fosforilació a nivell de substrat. Aquesta reacció és irreversible i molt exergònica.