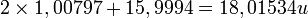Malas
Clasificado en Física
Escrito el en  español con un tamaño de 5,69 KB
español con un tamaño de 5,69 KB
La ley de conservación de la masa o ley de conservación de la materia o ley de Lomonósov-Lavoisier En una reacción química ordinaria la masa permanece constante, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos
La ley de Dalton o ley de las proporciones múltiples formulada en 1803 por John Dalton, es una de las leyes estequiométricas más básicas. Fue demostrada por el químico y físico francés Louis Joseph Gay-Lussac.
La ley de las proporciones equivalentes llamada también ley de los pesos de combinación, ley de las proporciones recíprocas o ley de Richter-Wenzel Los pesos de los diferentes elementos que se combinan con un mismo peso de un elemento dado, son los pesos relativos a aquellos elementos cuando se combinan entre sí, o bien múltiplos o submúltiplos de estos pesos
El volumen molar de una sustancia, simbolizado Vm,[1] es el volumen de un mol de ésta. La unidad del Sistema Internacional de Unidades es el metro cúbico por mol:m3 · mol-1
Un mol de cualquier sustancia contiene 6,022 · 1023 partículas.[2] En el caso de sustancias gaseosas moléculares un mol contiene NA moléculas. De aquí resulta, teniendo en cuenta la ley de Avogadro, que un mol de cualquier sustancia gaseosa ocupará siempre el mismo volumen (medido en las mismas condiciones de presión y temperatura).
Experimentalmente, se ha podido comprobar que el volumen que ocupa un mol de cualquier gas ideal en condiciones normales (Presión = 1 atmósfera, Temperatura = 273,15 K = 0 °C) es de 22,4 litros. [3] Este valor se conoce como volumen molar normal de un gas.
Este valor del volumen molar corresponde a los llamados gases ideales o perfectos; los gases ordinarios no son perfectos (sus moléculas tienen un cierto volumen, aunque sea pequeño) y su volumen molar se aparta ligeramente de este valor. Así los volúmenes molares de algunos gases son:
Monóxido de carbono (CO) = 22,4 L.
Dióxido de azufre (SO2) = 21,9 L.
Dióxido de carbono (CO2) = 22,3 L.
En el caso de sustancias en estado sólido o líquido el volumen molar es mucho menor y distinto para cada sustancia. Por ejemplo:
Para el nitrógeno líquido (–210 °C) el volumen molar es de 34,6 cm3.
Para el agua líquida (4 °C) el volumen molar es de 18,0 cm3.
La masa atómica (ma) es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada.[1] La masa atómica puede ser considerada como la masa total de protones y neutrones en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos.
El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de
| 1 mol = |
| 6,022 141 79 (30) × 1023 |
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Su unidad es el Dalton o unidad de masa atómica, que se abrevia u (antes uma).
La masa molecular se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia. A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular. La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,00797, masa atómica del O: 15,9994)
Se multiplica por 2, ya que la molécula de agua contiene 2 átomos de hidrógeno (H).